
|
| |||
|
Разделы
Главная
Сапромат
Моделирование
Взаимодействие
Методы
Инновации
Индукция
Исследования
Факторизация
Частоты
Популярное
Как составляется проект слаботочных сетей?
Как защитить объект?
Слаботочные системы в проекте «Умный дом»
Какой дом надежнее: каркасный или брусовой?
Как правильно создавать слаботочные системы?
Что такое энергоэффективные дома?
|
Главная » Эндотелийзависмый механизм 1 2 Эндотелийзависмый механизм регуляции градиента давления и линейной скорости в артериальном русле человека Филатова О.В. (kon-filatov@yandex.ru), Киселев В.Д., Томилова И.Н. Алтайский государственный университет, Барнаул, 656099 Введение Известные теоретически и экспериментально сведения о гидродинамических и иных процессах, протекающих в отдельных кровеносных сосудах и группах сосудов, в различных органах и экстракорпоральных устройствах, сводятся воедино при построении моделей сердечно-сосудистой системы в целом или ее частей - артериальной и венозной. Традиционно сосудистое русло представляют в виде системы ветвящихся трубочек разного диаметра: крупные артерии, подводящие кровь от сердца к органам, мелкие резистивные сосуды, определяющие величину кровотока в каждом органе, капилляры, обеспечивающие обмен между кровью и органами, и венозные сосуды, обеспечивающие возврат крови к сердцу [9]. На подводящих артериях падение давления меняется пропорционально кровотоку, что отражает традиционную точку зрения, согласно которой этот участок сосудистого русла считается практически пассивным. Однако для состояний увеличения кровотока с большой кратностью эта точка зрения приводит к противоречиям. Поскольку уже в покое среднее давление в бедренной артерии кошек ниже среднего давления в дуге аорты примерно на 10% [14], то ясно, что считать подводящие сосуды пассивными трубками при более чем десятикратном увеличении кровотока в органе при рабочей гиперемии просто невозможно. Падение давления имеет место в магистральных сосудах [3], что является лимитирующим фактором интенсификации периферического кровотока. Все сосудистое русло, включая и подводящие артерии, должно адаптироваться при многократном увеличении потребности органа в крови [3]. Исследования последних 25 лет, касающиеся роли эндотелия в регуляции сосудистого тонуса, изменили точку зрения на артерии как на пассивные трубки. Существование эффекта стабилизации падения давления было показано в опытах, в которых измерялась указанная разность давления [11]. Поскольку определяемая эндотелием стабилизация падения давления присуща как малым артериям, так и артериолам, естественно ожидать, что такое их свойство каким-то образом проявляется и в реакциях на рост кровотока артериальной системы, будь то русло отдельных органов или все это русло. Однако данные, касающиеся стабилизации падения давления, были получены на изолированных артериях [2, 3]. Вопрос о том, в какой мере эффект стабилизации давления принадлежит отдельным артериям, и как он распределяется по трассе аорта - артериолы остается открытым. Интерес к данной проблеме связан также с тем, что участие эндотелийзависимого механизма в реакциях системной гемодинамики на физиологические раздражители практически не изучено [4]. Целью настоящей работы явилось восстановление гипотетической кривой градиента давления вдоль сосудистого русла с использованием современных возможностей математического моделирования, изучение количественных характеристик артериальных сосудов на трассе от аорты до мелких артерий с использованием модели артериального древа человека с распределенными параметрами А. Ноодерграафа [1], где детально представлены геометрические и биомеханические свойства сосудистого русла человека. Методика Конструкция модели Для решения поставленных задач мы построили математическую модель артериального русла человека, используя физическую модель А. Ноодерграафа [1]. Модель артериального древа человека с распределенными свойствами была разработана и сконструирована А. Ноордерграафом и соавторами. Первоначальный аналог имитировал отдельно 113 сегментов артерий, каждый длиной около 5 см. Все сегменты соединялись друг с другом в соответствии с артериальным древом человека. Она считается основным прототипом и описана здесь довольно подробно вместе с результатами первоначального сравнения со скудными данными о свойствах реальной системы, имевшимися в то время. Предполагалось, что каждая артерия имеет цилиндрическую форму с круговым поперечным сечением, течение ламинарно и осесимметрично. Все артерии были закреплены в продольном направлении (т. е. невозможны никакие движения стенки сосуда в этом направлении), входные эффекты и особенности течения в окрестностях разветвления не учитывались. Радиусы, которые были затабулированы А. Ноордерграафом при конструировании исходной модели, относились к субъекту росторм 175 см и весом 75 кг. Таблица значений дана Н. Вестергрофом [1]. Следует заметить, что толщина стенки составляет примерно 10% внутреннего радиуса крупных сосудов и 25% - для мелких сосудов. Общая длина моделируемых артерий составляет 720 см. Полагалось, что вязкость крови равна 3-10 спуаз и плотность крови составляет 1,05 г/см . Существенным недостатком этой модели является отсутствие звена эндотелийзависимой поток-индуцируемой регуляции артерий. Построение модели с учетом поток-зависимой регуляции диаметра артерий кровеносной системы человека, детальная разработка параметров объемного кровотока в норме и при максимальной нагрузке посредством математических вычислений дают возможность получить градиенты давления на каждом сегменте артериального русла при неинвазивном исследовании. Модель А. Ноодерграафа уточнена и дополнена сегментами, включающими такие сосудистые секции, как артериолы (28 А) и капилляры (29 А) (рис. 1). Роль эндотелийзависимой поток-индуцируемой регуляции диаметра артериальных сосудов исследовалась на участке 4А - 29 А модели (рис. 1). Различные радиусы, длины, вместе с другой информацией, касающейся артериальных сегментов, представленных в модели, приводятся в таблице. 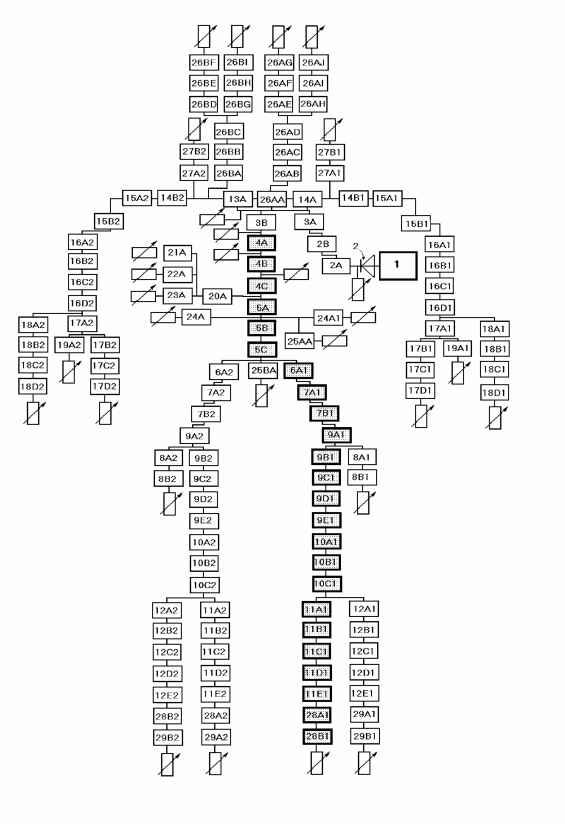 Рис. 1 Схема электрической модели артериального древа Объяснение номеров выделенных сегментов, названий артерий и данных дано в таблица. человека. числовых Таблица Числовые данные для сегментов, изображенных на рисунке 1 * - обозначены расчетные параметры
Продолжение таблицы
Результаты исследования Параметры объемного кровотока Сердце в организме человека средней массы в состоянии покоя перегоняет приблизительно 5 л крови в минуту. Измерения регионарного кровотока в покое показали, что головной мозг получает 14%, сердце 3,5 -5%, желудочно-кишечный тракт 23%, почки 22%, мышцы 18%, кожа 4%, остальное (кости, жировая ткань, соединительная ткань и т.п.) - 14% от общего минутного объема [9]. Исходя из потребностей каждого региона в количестве кровотока рассчитывалась объемная скорость потока крови на отдельных участках модели артериального древа человека. Учитывая вклад таких регионов, как сердце и головной мозг, верхние конечности объемную скорость кровотока в сегменте 4 А рассчитали по следующей формуле: 5 л - 0,8 л (голова, головной мозг 14% + кости головы, соединительная ткань и т. п.) - 0,18 л (коронарный кровоток) - 1 л (верхние конечности) = 3,02 л. После распределения кровотока в артерии желудочно-кишечного тракта скорость в сегменте 5А составила 1,77 л/мин. С учетом почечного кровотока объемная скорость в сегменте 5В равна 0,52 л/мин. Arteria mesenterica inf. (сегмент 25ВА) забирает 0,12 л/мин. Таким образом, после бифуркации аорты скорость в подвздошных артериях составила 0,2 л/мин (участок 6А - 9А). После ответвления arteria profundus (сегменты 8А, 8В) от arteria femoralis скорость кровотока составила 0,1 л/мин (сегменты 9В - 10С). После разветвления arteria poplitea (10С) на arteria tibialis posterior (11А - 11Е) и arteria tibialis anterior (12А - 12Е) кровоток в arteria tibialis posterior (11А - 11Е) составил 0,073 л/мин. Давление Согласно закону Пуазейля формула для объемной скорости кровотока имеет вид [9]: П * r 4 * (P 1 - P 2) Q--87 Уравнение Пуазейля можно также упростить по прямой аналогии с первым законом Ома о соотношении между электрическим током, напряжением и сопротивлением [9]. Q ( P 1 - P 2) Q ~ R Где 8 l П Г Отсюда возможно рассчитать градиент падения давления на каждом участке артериального древа человека. A P = Q * R В обоих кругах кровообращения градиент падения давления Ра-Ру (Ра соответствует среднему аортальному давлению (90-110 мм рт. ст.) в большом круге, а Ру - центральному венозному давлению (практически равному нулю) поддерживается на довольно постоянном уровне [9]. Известный профиль падения давления в кровеносной системе [9] отражает изменение давления вдоль наиболее крупных сосудистых секций (артерии - артериолы, капилляры, венулы - вены). Используемая модель позволила рассчитать градиент падения давления на каждом сегменте модели. Эндотелийзависимая поток-индуцируемая регуляция и градиент давления Изученные регионарные особенности эндотелий-зависимых поток-индуцируемых реакций артерий кроликов в широком диапазоне объемной скорости потока выявили [8], что максимальная вазодилатация составила 12,2±0,84% в сонной артерии, 21,04+1,67% - в брюшной аорте, 19,8±3,81% - в чревном стволе, 23+3,8% - в подвздошной артерии, 21,94+4,15% - в почечной артерии, 109,24+16,34% - в бедренной артерии. Известно, что прирост диаметра более мелких, чем бедренная артерия, сосудов (например, артерия стройной мышцы) также доходит до 100% [7]. Даже в тех случаях, когда минутный объем, равный в покое 5 л/мин, увеличивается во время тяжелой нагрузки до 25 л/мин, градиент давления на участке 4А - 5С, рассчитанный с помощью модели, составил бы 2,03 мм рт. ст. по сравнению с 0,41 мм рт. ст. в покое. Реально, благодаря имеющей место поток-зависимой вазодилатации, АР на этом участке составил 1,43 мм рт. ст. (таблица). Известно, что мышечный кровоток максимально может увеличиваться 15-20-кратно [11]. Рассмотрев ситуацию, когда объемная скорость кровотока изменяется двадцатикратно, выявили, что градиент давления на участке 6А -9А составил бы 5,61 мм рт. ст., на участке 9В - 10С - 51,37 мм рт. ст., на участке 11 А - 11 Е - 38,37 мм рт. ст., то есть на уровне артерий (даже не артериол) давление снизилось бы до 0 мм рт. ст. (таблица). Если бы подводящие артерии вели себя как пассивные трубки, в случае многократного увеличения кровотока, они не смогли стабилизировать нужный градиент давления для поддержания исходного уровня механического нагружения мелких артерий. Экстраполяция данных полученных на животных [8] позволила выявить, что наличие эндотелийзависимой поток-индуцируемой вазодилатации позволяет снизить градиенты давления на участке 6А - 9А до 3,89 мм рт. ст., на участке 9В - 10С до 8,15 мм рт. ст., на участке 11А - 11Е до 8,45 мм рт. ст. В целом величина давления на участке 11 Е для последнего случая составила 77,69 мм рт. ст., что согласуется с данными А. Holmberg [13] о том, что средний градиент давления в большом круге во время тяжелых нагрузок увеличивается только на 15-20%. Линейная скорость кровотока Расчет линейной скорости кровотока выявил, что скорость потока в сегменте 4А составила 26,58 см/с, затем снижается до 20 см/с в сегменте 4В, 15 см/с в сегменте 5 А, 10 см/с в сегменте 9 А, сохраняясь на этом уровне до сегмента 11 Е (таблица). В случае увеличения МОК до 25 л/мин, линейная скорость резко возрастает на участке 4А (92,23 см/с), затем снижается на участке 4 В (69,44 см/с), понижаясь к участку 5 А до 52 см/с. Расчет линейной скорости потока в случае, если бы сосуд вел себя как пассивная трубка, продемонстрировал, что увеличение диаметра артерий на участке 4А - 7 В на 20% снижает линейную скорость в 1,44 раза (таблица). При двадцатикратном увеличении мышечного кровотока линейная скорость возрастает до 50 см/с. В случае 20-кратного увеличения объемной скорости потока двукратное увеличение диаметра бедренной артерии понижает величину линейной скорости потока в 4 раза (таблица). Расчет числа Рейнольдса [9] демонстрирует, что в сегменте 4А величина его достигает 1770, что близко к величине его критического значения (2000) (рис. 2). ее о ч а ч о X о ч 10000 п 9000 8000 7000 6000 5000 4000 3000 2000 1000 0  £ # & # Сегменты модели ReRe max Re max ж. т. Рис. 2. Изменение числа Рейнольдса на участке aorta thoracalis - a. tibialis posterior. Расчеты на модели демонстрируют, что число Рейнольдса прогрессивно снижается к артериолам (рис.2). Как показали расчеты на модели, в случае 1 2 |
|
| |||