
|
| |||
|
Разделы
Главная
Сапромат
Моделирование
Взаимодействие
Методы
Инновации
Индукция
Исследования
Факторизация
Частоты
Популярное
Как составляется проект слаботочных сетей?
Как защитить объект?
Слаботочные системы в проекте «Умный дом»
Какой дом надежнее: каркасный или брусовой?
Как правильно создавать слаботочные системы?
Что такое энергоэффективные дома?
|
Главная » Закономерности Закономерности изменения стандартных энтальпий образования родственных соединений в бинарных и псевдобинарных системах Моисеев Г.К. (1), Ивановский А.Л. (ivanovskii@ihim.uran) (2) (1) Институт металлургии УрО РАН, г. Екатеринбург. (2) Институт химии твердого тела УрО РАН, г. Екатеринбург Предложен метод коррекции известных и оценки неизвестных величин стандартных энтальпий образования (СЭО) для групп родственных бинарных и псевдобинарных соединений, основанный на оценках энергии образования молекулы соединения, приведенной к единице её среднего заряда, и связи с числом атомов в молекуле. Достоверность результатов термодинамического анализа, в частности, термодинамического моделирования [1], зависит от точности определения термохимических параметров реагентов и, в первую очередь, их стандартных энтальпий образования (СЭО). Проблема не может быть решена с применением только экспериментальных методик. Поэтому большое значение получают модельные подходы, позволяющие выявить закономерности изменения СЭО неорганических веществ в зависимости от их физико-химических, энергетических, структурных характеристик (см., например, [2-7]). В настоящей работе предложен метод оценки стандартных энтальпий образования (СЭО^Р) бинарных и квазибинарных родственных соединений в различных неорганических системах в зависимости от величины среднего заряда конкретного соединения (в ряду родственных), а также значения энергии образования молекулы соединения в расчете на единицу ее среднего заряда. Для бинарного (псевдобинарного) соединения AxBy в конденсированном (или газообразном) состоянии можно ввести понятие среднего заряда (Zi) как: Z(AxBy) = x(A) ZA + x(B) Zb, где x(i) - мольная доля, Zi - заряд ядра (номер в Периодической системе) i-го элемента в молекуле. Для AxBy введем также величину энергии образования Ei, приведенную к среднему заряду молекулы: Ei = AHo289i/(NA Zi), где AHo289i -стандартная энтальпия образования соединения AxBy>, NA - число Авогадро. Для расчетов Ei использовали данные [8,9] о величинах AHo289 для групп однотипных соединений (не менее 4 в группе) и анализировали зависимости: Ei = f (x+y)i (1) Затем величины EiP и СЭО^Р рассчитывали как: СЭО^р = Eip Zi/K, (2) и сравнивали полученные значения СЭО^Р с исходными данными [8]. Определенные таким образом величины Zi, EiP и СЭО^Р для 53 соединений в 10 различных системах и стандартные энтальпии образования AHo289 по данным [8] приведены в Таблице. Примеры зависимости (1) иллюстрирует рисунок; соответствующие уравнения для каждой системы даны в Таблице. Из представленных данных можно сделать ряд выводов. 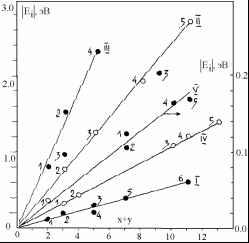 Рисунок. Зависимости Ei = f (x+y)I для соединений в системах: I - V-B (1-6 - VB, VB2, V2B3, V3B2, V3B4, V5B6); II - TiO (1-5 - TiO, TiO2, Ti2O3, Ti3O5, TUO); III - BaO-SiO2 (l-4 (BaO)(SiO2), (BaO)(SiO2)2, (BaO)2-(SiO2), (BaO)2-(SiO2)3); IV - U-O (1-5 - UO2, UO3, U3O7, U3O8, U4O9); V - P-S (1-5 -P2S5, P4S3, P4S5, P4S6, P4S7). Приведены экспериментальные величины СЭО (*,о) по данным [8]. Таблица. Исходные данные [8] и результаты расчетов СЭО бинарных и псевдобинарных соединений
V3O7, Кроме того, для оксидов V5O9, V6O11, V7O13, V8O15, V9O,7, V9O 9, V6O3, которые проанализированы по исходным данным [9], 5 < ±1%. Существуют простые линейные зависимости между абсолютными величинами энергий образования молекул родственных соединений, приведенных к среднему заряду молекул, и числом атомов в молекулах. Среднее различие (5ср) расчетных и экспериментальных значений СЭО составляет ~ 12%; тогда как значения 5 для 12 из рассмотренных фаз гораздо больше: V3B2 (28.6), TiO (36.5), ThCo (-39.8), ThCo5 (-39.5), Tii2Co7 (-51.4), P4S5 (-29.7), VO (29.6), (BaO)2(SiO2) (30.6), 4B2H6 (48.7), B5H9 (-52.1), US (22.8), U2S3 (19.6 %). Представляется, что СЭО этих соединений, приведенные в [8], не являются вполне корректными. Поэтому есть основания считать для этих соединений рассчитанные нами значения более точными. Для группы родственных конденсированных соединений можно оценить их СЭО, если известна достоверная величина СЭО одного из соединений, упрощенным путем, поскольку при х+у = 0 значение Е| = 0. Поэтому зависимость (1) можно представить в форме: Ei ~ [K ifMZ* (x+y)*] (x+y)i (3) где индексом (*) обозначены характеристики для выбранного соединения. Рассчитав по (3) величины Ei остальных соединений, можно оценить их неизвестные СЭО| по (2). При этом важнейшее значение имеет достоверность величины стандартной энтальпии образования выбранного исходного соединения. Например, в системе Pb-О при выборе в качестве исходной величины СЭО (РЬО) = -218600 Дж/моль [8] среднее отклонение расчетных от справочных СЭО для всех оксидов составляет - 7.7 %; при выборe СЭО (Pb3O4) = -718400 Дж/моль [8] среднее отклонение равно ± 4.4%. Таким образом, в работе предложена и проверена методика коррекции известных и оценки неизвестных СЭО соединений в бинарных и псевдобинарных неорганических системах, основанная на понятии энергии образования молекулы соединения, приведенной к единице её среднего заряда, и её связи с числом атомов в молекуле. Работа выполнена при финансовой поддержке РФФИ (проекты 04-03-33109 и 0403-32082) Литература 1. Моисеев Г.К., Вяткин Г.П. Термодинамическое моделирование в неорганических системах. Челябинск. Изд. ЮУрГУ. 1999. 256с. 2. Морачевский А.Г., Сладков И.Б., Термодинамические расчеты в металлургии. - М.: Металлургия. 1994. 304с. 3. Касенов Б.К., Алдабергенов М.К., Пашинкин А.С, Термодинамические методы в химии и металлургии. Алматы: Рауан-Демеу. 1994. 256с. 4. Резницкий Л. А. Кристаллоэнергетика оксидов. М.: Диалог. МГУ, 1999. 171с. 5. Моисеев Г.К., Ватолин Н.А., Маршук Л.А., Ильиных Н.И. Температурные зависимости приведенной энергии Гиббса некоторых неорганических веществ. Екатерин-бург: Изд. УрО РАН. 1997. 230с. 6. Моисеев Г. К., Ватолин Н. А. Некоторые закономерности изменения и методы расчета термохимических свойств неорганических соединений. Екатеринбург: Изд. УрО РАН. 2001. -135с. 7. Моисеев Г. К. Оценка термохимических свойств и термодинамических функций некоторых летучих и конденсированных кластеров щелочных металлов Расплавы. 2003. N4. С.35-48. 8. Yokokawa H. Tables of Thermodynamic Properties of Inorganic Compounds J. Nat. Chem. Lab. Industry. Spec. IsS. 1988. V.83. P.27-121. 9. Yokokawa H., Sakai N., Kawada T., Dokiya M. Chemical potential diagrams for Rare earth-Transition Metal-Oxygen Systems J. Amer. Ceram. Soc. 1990. V.73.N3.P.649-661. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| |||