
|
| |||
|
Разделы
Главная
Сапромат
Моделирование
Взаимодействие
Методы
Инновации
Индукция
Исследования
Факторизация
Частоты
Популярное
Как составляется проект слаботочных сетей?
Как защитить объект?
Слаботочные системы в проекте «Умный дом»
Какой дом надежнее: каркасный или брусовой?
Как правильно создавать слаботочные системы?
Что такое энергоэффективные дома?
|
Главная » Расчет Расчет поля в окисле тантала в процессе гальвано статического окисления Авдеев Н.А. (navdeev @psu.karelia.ru), Савенков Г.Ю. Петрозаводский Государственный Университет Введение Взаимосвязь между ионным током и напряженностью поля в гальваностатическом режиме окисления тантала была впервые экспериментально обнаружена Гюнтершульце и Бетцем [1]. j = A exp(BE) (1) где j - плотность тока, а А и B - зависящие от температуры константы. Общее уравнение, учитывающее сильные и слабые поля, имеет вид j = 2a sh be. Для слабых полей оно переходит в j = 2abe (закон Ома) и для сильных полей в уравнение Гюнтершульца и Бетца (1). Из приведенных выше уравнений следует, что зависимость e ~ ln j должна быть линейной. Наклон этой прямой дЕ / д ln j называется коэффициентом Тафеля по аналогии для обычных электродных процессов. Экспоненциальная зависимость объяснялась влиянием поля на высоту потенциальных барьеров, которые контролируют скорость перемещения внедрённых ионов по междоузлиям в объеме окисла и может быть представлена выражением j = 2aCMvq exp[-(W - zFas)/RT ] (2) где j -плотность ионного тока, а - полуширина барьера, cm - концентрация ионов в плёнке, v - частота колебаний ионов, w - энергия активации при нулевом поле, z - заряд иона, f - постоянная Фарадея. Позднее Мотт и Кабрера [2] предположили, что процесс анодного роста окисла определяется скоростью образования ионов на границе металл/плёнка. В этом случае, выражение для тока имеет вид: j = Cm , svsq exp[-(W-zFrte)/RT ] (3) где Cm,s - концентрация ионов на границе окисла, vs - частота колебаний, W -энергия активации ионов при нулевом поле, а' - полуширина барьера. Представленные модели достаточно подробно описаны в литературе [3,4] и активно используются в настоящее время для описания процесса электрохимического окисления, сопровождающегося образованием окисла на поверхности электрода. Несмотря на широкое применение этих моделей, оказалось, что их использование приводит к расхождению с экспериментом: во-первых, уравнения (1)-(3) предсказывают, что график зависимости энергии активации W - qaE от напряженности электрического поля должен быть линейным, а предэкспоненциальный множитель А не зависит от E. Однако, слабое искривление зависимости Тафеля в эксперименте с танталом объясняется тем, что энергия активации - нелинейная функция от приложенного поля и, что а, также зависит от напряженности поля. во-вторых, наклон Тафеля, (SE/dln j), который определяется выражением kT/qaE, должен быть пропорционален абсолютной температуре, что не наблюдается при окислении поверхности, например, тантала, ниобия и циркония. В настоящее время отсутствует удовлетворительное объяснение приведенных расхождений. Очевидно, требуются привлечение более реальных моделей [5]. В данной работе процесс анодного окисления рассматривается с позиций модели, учитывающей одновременное влияние условий дрейфового переноса ионов через объем, образующей окисной фазы, и электрохимического потенциала на границах окисла. Определяется вклад заряда подвижных ионов. 1. Теоретическая модель В представленной работе процесс анодного окисления рассматривается с точки зрения миграционного механизма переноса ионов, окисляющих поверхность металла. Это могут быть, например, ионы О-2 OH--, проникающие сквозь пленку [6]. Присутствие отрицательного заряда в анодных окислах в процессе их роста обнаружено экспериментально в работе [7]. В предлагаемых расчетах, определяется совместное решение для миграционного тока и уравнения Пуассона. Воспользуемся соотношением для потока ионов j = qp- c( x)e (x) = const (4) Величину напряженности поля можно представить выражением e (x) =--гт (5) q - p - c( x) После дифференцирования получаем соотношение de (x) = j dc( x) dx qp - c( x)2 dx которое, используя уравнение Пуассона de ( x) qc( x) dx 4tzss0 можно преобразовать к виду dx 4nss0 - j решение этого уравнения запишется в виде dc(x) + q2 -p-c(x)3 = 0 j - 4nss0 2q2 p- (x + x0) где n j- 4nss0 x0 = -C1 Подстановка соотношения (9) в уравнение Пуассона (7), позволяет определить зависимость напряженности поля от координаты. е ( X): 2j (X + X0) (10) Л 4nss0 Для поиска константы С1 можно воспользоваться соотношением определяющим концентрацию сь активных ионов через и концентрационное перенапряжение гц у границы окисла где происходит электрохимическая реакция [8]. c( L) = c0exp qn (11) Приравняв соотношения (9) и (11) в точке x = L, находим вид постоянной x0. х = j - 4nss0 L (12) X0 =-о--L 2q /л- c0 exp--kT Подставляя значение x0 в выражение (10), получаем зависимость, определяющую распределение напряженности поля по координате внутри растущего окисла e ( x ) 2- j(X-L) -rj2-2expf-2qn1] (13) 2. Результаты Интерпретация полученных выражений на основе принятой модели требует проведения численной оценки и сравнения с экспериментальными данными, представленными в работе Юнга [3]. Расчеты зависимости E ~ Ln j проводились для электрохимического окисления тантала, так как в этом случае ток через растущий окисел на 100% определяется переносом ионов. Порядок величины потенциала гц ~ (0.2 В) можно определить, используя данные, приведенные в [3]. Оценка значения постоянной скорости химической реакции производится по кинетическим зависимостям роста окисной пленки Ta2O5 [9]. Подстановка этих значений в выражение (13) позволяет рассчитать и построить зависимость в координатах Тафеля dE/dLn j, провести сравнение с экспериментальными результатами, представленными в работе Юнга [3]. Результаты расчета приведены на рис. 1. В области малых плотностей тока, когда заряд в окисле незначителен расчитанная зависимость (13), хорошо спрямляется в координатах E ~ Ln j и практически линейна. Заметное отклонение расчетного графика (рис.1.) от линейности наблюдается при больших токах, начиная со значений (lgj = -3), что соответствует плотности тока j = 10 mA/cm2. Расчетная зависимость Тафеля, построенная без учета поля, обусловленного зарядом подвижных ионов, приводила к значительному отклонению графика от типичного вида кривых, полученных на основе экспериментальных значений (рис.1 зависимость 4). Экспериментальные результаты для определения наклона Тафеля приведены в координатах U ~ Ln j, поэтому для сравнения выражение (13) было преобразовано в зависимость между током и падением напряжения на окисле. В этом случае напряжение определяется как интеграл по толщине u(х) = je(x)dx + u0 . Зависимость между током и напряжением, рассчитанная таким образом, также спрямляется в полулогарифмических координатах U ~ Ln j. Сравнение расчетной и экспериментальной [3] зависимостей U~Ln j, полученных для электрохимического окисления тантала, показывает их полное совпадение (рис. 2). lg j, А/см -1,5 п -2 -2,5 -3 н -3,5 -4 ] -4,5 -5 -5,5 -6 -6,5 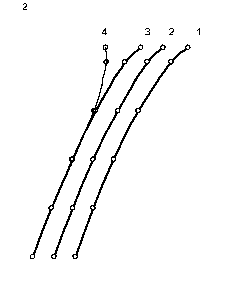 E, МВ/см Рис.1 Зависимость напряженности поля в окисле от логарифма плотности ионного тока при x = Lox, для температур: 1. - 2730К, 2. - 2980К, 3. - 3230К. 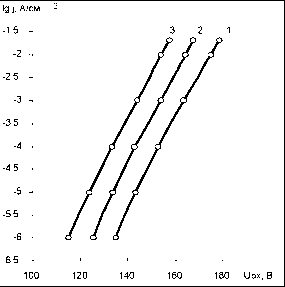 Рис.2 Зависимость напряжения на окисле от логарифма плотности ионного тока для толщины окисла Lox = 2500 А для температур: 1. t = 00С, 2. t = 250С, 3. t = 500С. Построение расчетных значений в координатах U~ln j показывает искривление этой зависимости по всему диапазону напряжений (рис.2), что отмечалось в качестве несоответствия с ранее принятыми моделями [3,4]. Данный результат является следствием интегрирования напряженности поля по координате и определяется зарядом подвижных ионов. Смещение прямой вдоль оси напряжений (рис.2) для различных температур, наблюдаемое в эксперименте, можно воспроизвести, подбирая в (13) значение подвижности. Например, если подвижность при Т=298К 13 2 13 2 составляла 4-Ю м /Вс, то при Т=323К увеличивалась до 4.35-Ю м /Вс. 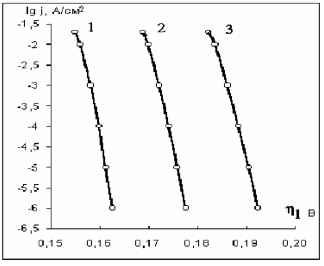 Рис.3 Изменение потенциала гц от плотности тока при температурах: 1.- t = 00С, 2. - t = 250С. 3. - t = 500С. 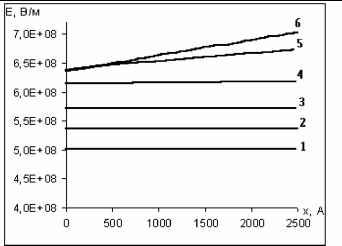 Рис.4 График распределения поля по толщине окисла Lox =2500 A от плотности тока: 1.-0.001 ma/cm2, 2. -0.01 ma/cm2 3. 0.1 - ma/cm2,4. -1 ma/cm2 5.-10 ma/cm2, 6 - 20 ma/cm2. Следует отметить еще одну особенность предлагаемой модели. Зависимость (13) спрямляется в координатах Тафеля при соблюдении соотношения ~ ln j между электрохимическим потенциалом на границе, который определяет скорость процесса окисления, и плотностью тока. Эта зависимость получена подбором значения потенциала до совпадения расчетной и экспериментальной кривых Ln j от u (рис.2) и представлена на рис. 3. Изменение потенциала на границе, с позиций электрохимической кинетики приводит к увеличению тока реакции и росту концентрации подвижных ионов. Выражение (13) позволяет получить вид распределения поля по толщине окисла. Распределение напряженности поля по толщине для различной плотности тока представлено на рис.4. Поле в окисле практически постоянно по толщине до плотности тока 10 ма/см2 и линейно уменьшается при более высоких плотностях тока, от внешней к внутренней границе окисла. З.Обсуждение Выражение (13), полученное на основе уравнений для миграционного тока, уравнения Пуассона и уравнения Нерста для электрохимической реакции, определяет полулогарифмическую зависимость между напряженностью поля и током e~ ln j и хорошо спрямляется в координатах Тафеля только при выполнении условия п1 ~ ln j что подтверждает предположение о граничных условиях диффузионно - дрейфового уравнения, сделанное в работе [10]. Подкоренное выражение в формуле (13) состоит из двух слагаемых. Первый член этой суммы получается путем интегрирования уравнения Пуассона (7) и определяет зависимость поля в окисле от величины плотности тока подвижных носителей. Поле, создаваемое зарядом подвижных ионов, противоположно внешнему полю, так как всегда координата x < L. С возрастанием плотности тока, возрастает поле, что приводит к искривлению зависимости e ~ ln j, особенно в области больших токов (lnj ~ 2) (рис.1), где коэффициент Тафеля de / д ln j возрастает, что обусловлено уменьшением суммарного поля. Поле заряда подвижных ионов уменьшается с приближением к границе, где образуются подвижные ионы и поэтому в точке (х-L) суммарное поле максимально. Второй член уравнения (13) представляет поле, которое определяется заданной плотностью тока гальваностатического режима, концентрацией c(L), подвижностью ионов ц. Предэкспоненциальный множитель представляет поле, которое можно выразить омическим соотношением e0 = j/q/uc0 для равновесного состояния системы. Поляризационная характеристика в случае химической реакции образования окисла имеет малые значения перенапряжения и практически I I kt линейна. Если Ы << - = 0,025 экспоненту можно разложить в ряд и, ограничившись двумя первыми членами разложения, получить соотношение eLox * E0 i1 - 41 (14) Воспользуемся условием непрерывности тока и выразим перенапряжение окисления металла на границе окисел - электролит через перенапряжение реакции образования ионов кислорода г2 на границе окисел -металл. j = jMe exp f) = j8exp[-] ( > kT l jO + (16) Связь между напряженностью поля и током можно получить, если подставить в выражение (14) значения перенапряжения г 1 выраженное через г 2 согласно (16). elox * e0 (1 - ln jO + ln j) (17) Уравнение (17) в явном виде отражает логарифмическую зависимость поля от плотности тока E ~ ln j. Температурную независимость наклона Тафеля можно объяснить пропорциональным изменением потенциала r\i, с ростом температуры рис.3. Заключение Получено аналитическое выражение, которое определяет взаимосвязь между плотностью тока и напряженностью поля в окисле в процессе гальваностатического режима анодного окисления. Показано влияние потенциала электрохимической реакции на величину напряженности электрического поля в окисле. Проведены расчеты, подтверждающие полулогарифмическую зависимость г 1 ~ ln j между изменением потенциала г 1 на границе окисла, где происходит образование окисла и плотностью тока. Слабое искривление зависимости U ~ ln j объясняется влиянием поля, создаваемого зарядом подвижных ионов в окисле тантала. Смещение кривых U ~ ln j в сторону меньших напряжений с ростом температуры можно объяснить увеличением подвижности. Рассмотрение процесса анодного окисления с позиций взаимосвязи дрейфового тока в объеме и электрохимической реакции на границе окисла, с учетом поля заряда подвижных ионов наиболее адекватно отражает кинетические зависимости. Такой подход исключает противоречия, используемых в настоящее время барьерных моделей переноса с экспериментальными данными. Литература 1. Gunterschulze A. and Betz H., Z. Phyz., 1934, 92, 367. 2. Cabrera N, and Mott N. F., Repts Prog. Physics 1948 -49, 12, c. 163. 3. Л. Юнг Анодные окисные пленки Л.:Энергия, 1967 4. Л. Л. Одынец, В.М. Орлов Анодные окисные пленки Ленинград, Наука , 1990. 5. Lei Zhang, Digby D. Macdonald, J.Electrochem. Soc. Vol. 144, No.3, March 1998 6. Васько А. Т., Ковач С. К. Электрохимия тугоплавких металлов К.: Техшка, 1983. - 160 с. 7. Зудов А.И., Наймушина С.И. Электретный эффект и электрическая релаксация в твердых телах. М.; изд. МИЭМ, 1988. С.92-98. 8. Дамаскин Б.Б. Основы теоретической электрохимии Москва Высшая школа , 1978. 9. Авдеев Н.А., Сиговцев Г.С. О математических моделях процессов анодного окисления. Труды Петрозаводского университета. Прикладная математика и информатика (вып. 9), 2000 г. с. 57 . 10. Авдеев Н.А., Якушева Л.С. Кинетика анодного окисления Материалы 54-й научной студенческой конференции, Петрозаводск 2002. |
|
| |||