
|
| |||
|
Разделы
Главная
Сапромат
Моделирование
Взаимодействие
Методы
Инновации
Индукция
Исследования
Факторизация
Частоты
Популярное
Как составляется проект слаботочных сетей?
Как защитить объект?
Слаботочные системы в проекте «Умный дом»
Какой дом надежнее: каркасный или брусовой?
Как правильно создавать слаботочные системы?
Что такое энергоэффективные дома?
|
Главная » Химическая поляризация Химическая индуцированная поляризация ядер в реакции Et3Al C CCl4, катализированной Pd(acac)2 Садыков Р.А. (ink@anrb.ru), Петров П.Н., Титова И.Г., Джемилев У.М. Институт нефтехимии и катализа РАН, г. Уфа Интерес к реакциям алюмоорганических соединений (АОС) с галогенметанами в присутствии комплексов переходных металлов первоначально был вызван тем что, они инициируют радикальную полимеризацию виниловых мономеров [1]. Было установлено, что инициирование радикальной полимеризации наблюдается только на первой стадии реакции. Через определенное время данная реакция приобретает бурный характер, сопровождается выделением большого количества газообразных продуктов и при этом инициирование радикальной полимеризации прекращается [2]. Позже радикальные стадии в подобных реакциях были изучены методом химической индуцированной динамической поляризации ядер (ХПЯ) [3]. Было найдено, что взаимодействие Et3Al c CCl4 или CHCl3 в присутствии Ni(acac)2, действительно протекает в две стадии. Эффекты ХПЯ и, соответственно радикальные процессы, обнаруживаются преимущественно на первой стадии реакции. В результате было показано, что ХПЯ возникает в диффузионной радикальной паре (РП) этильного и трихлорметильного (дихлорметильного в случае СHCl3) радикалов, образующихся в процессе взаимодействия Et3Al и CCl4 (CHCl3) с комплексом переходного металла. В работы [3,4] впервые описаны примеры изучения методом ХПЯ каталитических реакций с участием АОС. На второй стадии в этих реакциях эффектов ХПЯ обнаружить не удалось, что согласуется с фактом прекращения инициирования радикальной полимеризации. Дальнейшее изучение реакции АОС с галогенметанами в присутствии комплексов и солей переходных металлов показало, что эти реакционные системы способны в мягких условиях активировать инертные C-C и C-H связи в насыщенных углеводородах. В этих условиях наряду с реакциями изомеризации и димеризации наблюдаются и скелетные превращения исходных углеводородов с разрывом С-С и С-Н связей [5]. С целью развития исследования процессов образования и гибели радикальных интермедиатов в каталитических реакциях АОС с галогеналканами в настоящей 1 13 работе методом ХПЯ Н и С изучена первая стадия реакции Et3Al c CCl4 в присутствии Pd(acac)2 в углеводородных растворителях. В предыдущих работах [3,4], в которых изучались реакции Et3Al c CCl4 и СHCl3 в присутствии Ni(acac)2 рассматривались только эффекты поляризации ядер 1Н. Экспериментальная часть В работе использовали 1 М раствор промышленного 98% Et3Al в D12-циклогексане. Исходный CCl4 предварительно обрабатывали P2O5 и перегоняли. Для наблюдения ХПЯ 1 М раствор Et3Al в D-циклогексане, содержащий 2-4 мг Pd(acac)2, в атмосфере аргона помещали в 5 мм ампулу для ЯМР измерений и предварительно регистрировали спектр ЯМР исходного раствора. Затем непосредственно в датчике спектрометра при комнатной температуре с помощью шприца добавляли в ампулу определенное количество раствора CCl4. Начиналась 1 13 бурная реакция, в течение которой регистрировали спектры ЯМР Н или С на спектрометре JEOL FX-90Q с рабочими частотами 89.5 МГц для 1Н и 22.5 МГц для Анализ продуктов реакции проводили с применением хроматографа Chrom-5 с капиллярной колонкой (25 м, 5% SE-30), а также хромато-масс-спектрометра Finnigan-4021 . Соединения идентифицировали с помощью библиотеки масс-спектров NBS (США), содержащей 75000 масс-спектров. Обсуждение результатов Взаимодействие Et3Al c CCl4 в присутствии Pd(acac)2 в углеводородных растворителях при комнатной температуре происходит энергично со значительным экзотермическим эффектом и сопровождается выделением газообразных продуктов. Вторая стадия реакции [5], во время которой исходные насыщенные циклические и ациклические углеводородные растворители подвергаются скелетным превращениям, начинается после индукционного периода, зависящего, как правило, от температуры и концентраций реагентов. Это обстоятельство позволяет изучать первую стадию реакции, не затрагивая вторую. В условиях реакции исходный Et3Al практически количественно превращается в Et2AlCl. При этом образуются, в основном, газообразные этан и этилен и некоторое количество трихлорпропана. Взятый в реакцию CCl4
превращается в СHCl3, C2Cl6 и трихлорпропан. Избыток CCl4 возвращается из реакции неизменным. Эффекты ХПЯ мы наблюдали при проведении реакции в D-циклогексане в 5 мм ампуле для ЯМР спектроскопии, расположенной непосредственно в датчике 1 13 спектрометра ЯМР. Нами были обнаружены и изучены ХПЯ на ядрах Н и С, 1 13 соответственно на спектрометрах ЯМР 1Н и ЯМР 1JC Знаки поляризации ядер, химические сдвиги сигналов и их отнесение приведены в таблице 1. Таблица 1. Химические сдвиги и знаки поляризации продуктов реакции(С2Н5)3А1 (1М, 0.4 мл) c CCl4(l:1.5) в присутствии Pd(acac)2 (~2 мг) в C(Pn при комнатной температуре. Рис. 1. ХПЯ Н в реакции Et3Al c CCl4 в присутствии Pd(acac)2: (1) - Спектр ЯМР Н исходного раствора Et3Al (1М, 0.4 мл) и Pd(acac)2 (~2мг) в П12-циклогексане; (2,3,4) - в ходе реакции в разные моменты времени после добавки О.бммоль CCl4; (5) - продукты реакции. Спектры ЯМР 1Н исходного раствора Et3Al, а также реакционной смеси в условиях реакции и продуктов реакции приведены на рис.1. Отнесения сигналов в 1 13 спектрах ЯМР Н и С сделаны на основании литературных данных, а также спектров заведомо известных соединений. В спектрах ЯМР 1Н наиболее интенсивная интегральная поляризация ядер наблюдается у протонов хлороформа (эмиссия) и трихлорпропана. У последнего метильные протоны имеют отрицательно поляризованный триплет (эмиссия), а метиленовые - положительно поляризованный квартет (адсорбция). В спектрах ЯМР С углерод хлороформа имеет положительно поляризованный сигнал (А). Трихлорметильный углерод трихлорпропана также поляризован положительно (А), а углерод метиленовой группы поляризован отрицательно (Е). На ядрах углерода гексахлорэтана регистрируется слабая эмиссия. Сигналы этилена и этана не поляризованы. В соответствии с теорией ХПЯ можно однозначно утверждать, что в образовании указанных соединений в данной реакции участвуют радикальные 1 13 интермедиаты. Известно, что интегральная поляризация ядер Н и С возникает в РП с неэквивалентными G-факторами. В нашем случае, очевидно это этильный и трихлорметильный радикалы. По литературным данным G(Et) = 2,00260 [6], G(CCL3) = 2,0091 [7]. 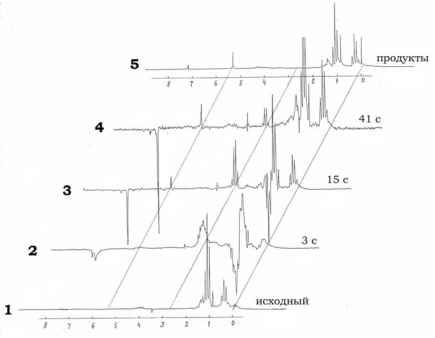 -F ЕЕ А А СНзСН2 СС1з рекомбинация* СН3СН2СС!3 (1) Поляризованные хлороформ и этилен образуются при внутриклеточном диспропорционировании данной пары (реакция 2). F Е А А Е СНХН; ССЦ -* СН2=СН2 +СНС13 (2) u 3WI 2 WWI3 диспропорционирование 22 3 Поляризованный гексахлорэтан вероятно образуется после диссоциации РП и последующей рекомбинации, случайно встретившихся, двух трихлорметильных радикалов (реакция 3,4). -F АЕ СН3СН2 СС,3 диссоциации СН3СН2 + СС!3 (3) СС!3 + СС!3 -С2С16 (4) 1 13 В реакциях 1-4 указаны знаки интегральной поляризации ядер Ни С, предсказанные в соответствии с правилами Каптейна в сильных магнитных полях [9]. Для интегральной поляризации правило Каптейна записывается в виде: r=u-e-AG-A(i) При взаимодействии Et3Al с CCl4 в циклогексане в отсутствии катализатора 1 13 поляризация ядер Н и С возникает в геминальной синглетной РП этильного и трихлорметильного радикалов [8], образовавшихся в одном элементарном акте. Из сравнения знаков поляризации ядер хлороформа и трихлорпропана, наблюдающихся в термическом и каталитическом вариантах видно, что в каталитическом варианте происходит инверсия знаков. Инверсия знаков может происходить при изменении мультиплетности РП. На этом основании можно полагать, что в каталитической реакции интегральная поляризация ядер возникает в триплетной диффузионной РП этильного и трихлорметильного радикалов. Трихлорпропан образуется при рекомбинации этой пары по следующей схеме (реакция 1) Электронный научный журнал ИССЛЕДОВАНО В РОССИИ 1 9 49 http: zhurnal.ape.relarn.ru/articles/2005/187.pdf где а = +1, если предшественником молекулы является триплетная или диффузионная пара, и а = -1, если предшественник - синглетая пара; е = +1 для продукта рекомбинации или диспропорционирования и е = -1 для продукта превращения радикалов, покинувших пару. Величина A(i) определяет знаки констант сверхтонкого взаимодействия (КСТВ) в радикалах. AG - разность G-факторов радикалов пары, которые определяются из спектров ЭПР этих радикалов. Значение Г > 0 соответствует фазе поляризации А, Г < 0 - эмиссия Е. Были использованы следующие значения КСТВ ядерных спинов метильных и метиленовых протонов со спином неспаренного электрона этильного радикала, соответственно, АН(СН3)=+2.687тТл и АН(СН2) = -2,238 тТл [6]. Для С известно Ac(CH3)=+38 тТл и Ac(CH2)<0 [10]. Для CCI3 радикала Ac(CCb)>0 [9,11]. Для примера определим знак поляризации для метиленовых протонов трихлорпропана, образовавшейся при рекомбинации диффузионной пары этильного и трихлорметильного радикалов по реакции (1). РП триплетная, поэтому д=+1. Для рекомбинации е=+1. AG = G(Et)-G(CCl3) =2.0026-2.0091< 0 Получаем Г= (-) (-) > 0, следовательно, метиленовые протоны должны иметь положительную фазу поляризации. Для метильных протонов получаем эмиссию, так как АН(СН3)>0 при прочих равных условиях. Сопоставление экспериментальных знаков поляризации продуктов (таб. 1) с предсказанными, показывает полное совпадение результатов. Этилен в эксперименте не поляризован. Одна пара протонов этилена образуется из метиленовых протонов этильного радикала, несущих усиленное поглощение, а другая пара протонов (=СН2) из метильных протонов того же радикала, имеющих отрицательную поляризацию. В спектре ЯМР 1Н этилена все четыре протона становятся эквивалентными и должны проявляться в виде незначительно поляризованного [12] синглетного сигнала из-за компенсации эффектов поляризации разных знаков. Диссоциация диффузионной РП приводит к выходу в раствор трихлорметильного радикала с отрицательно поляризованным углеродом. Далее этот радикал встречается с другим трихлорметильным радикалом, рекомбинирует с ним, в результате чего образуется гексахлорэтан с отрицательно поляризованным ядром углерода, сигнал которого мы наблюдаем в экспериментальных спектрах. Схема 1 EEA A рекомб. р диспропорц. AE CH3CH2CCl3 - CH3CH2 CCl3 -- СН2=СН2 + СНС13 дисоциация CCl E CH3CH2 + CCl3 - CCl3 - CCl3 При диссоциации диффузионной РП наряду с трихлорметильными радикалами в раствор выходят этильные радикалы, поляризованные продукты которого (например, этан) также должны наблюдаться в спектрах. Однако выход этана (45% относительно исходного Et3Al) намного превышает выходы других радикальных продуктов. Можно полагать, что этан в данной реакции образуется в основном по нерадикальным маршрутам, поэтому поляризация этана в спектрах не наблюдается. Таким образом, все наблюдаемые эффекты ХПЯ как на протонах, так и на ядрах углерода хорошо объясняются в рамках модели с диффузионной РП этильного и трихлорметильного радикалов и ее последующими превращениями. Радикальные стадии реакции можно представить в виде следующей схемы. Рассмотрим возможный путь образования этильных и трихлорметильных радикалов в каталитическом процессе. Согласно литературным данным результатом взаимодействия Et3Al с Pd(acac)2 является восстановление последнего [13]. При соизмеримых количествах Et3Al и Pd(acac)2 (Al/Pd<2) происходит обмен лигандами. Et3Al + Pd(acac)2 -* Et2Al(acac) + EtPd(acac) С увеличением количества Et3Al реакция протекает с образованием диэтилпалладия по схеме Pd(acac)2 + 2Al(Et)3 -- 2 Et2Al(acac) + PdEt2 В случае большого избытка Et3Al (Al/Pd > 10) данная реакция протекает мгновенно, образовавшийся PdEt2 нестабилен и легко распадается на Pd(0) и газообразные продукты (этан и этилен). Можно полагать, что часть PdEt2 распадается гомолитически с образованием этильного радикала. PdEt2-*- Pd(o) + C2H6 + C2H4 + CH3cH2 Pd(0) агрегируется и выпадает в виде коллоидного черного осадка. В нашем случае можно предположить, что атомарный Pd(0) реагирует с CCl4. Pd(o) + CCl4-- PdCl + CCl3 Предположение подтверждается известной реакцией Хараша [14], в соответствии с которой, реакция магнийорганического соединения RMgX c органическими Схема 2 Pd(acac)2 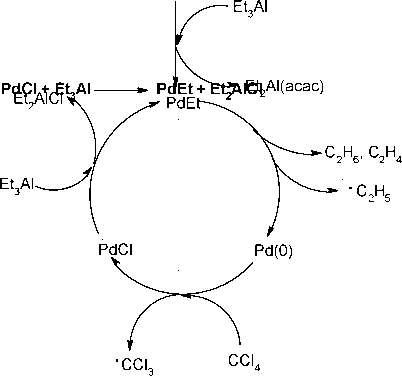 галогенидами, катализированная солями переходных металлов, приводит к генерированию промежуточных радикалов и продуктов типа R-R. M(o) + RHal -MHal + R Образовавшийся PdCl, снова реагирует с избытком Et3Al. На основании полученных экспериментальных результатов и литературных данных процесс образования основных продуктов и радикальных интермедиатов в реакции Et3Al с CCl4 в присутствии Pd+2 можно представить в виде следующего каталитического цикла (схема 2). Разработанная нами схема взаимодействия Et3Al c CCl4 в присутствии комплексов Pd полностью совпадает со схемой предложенной ранее для реакции Et3Al с CCl4 под действием Ni(acac)2 [4]. Это свидетельствует о том, что механизмы взаимодействия Pd(acac)2 и Ni(acac)2 с Et3Al в соответствии с литературными данными очень близки [13]. Литература 1. K.S. Minsker, Yu.A. Sangalov and G.A. Razuvaev, J. Polym.Sci.:Part C, 1967,N 16, 14891496 2. C. Eden and H.Feilchenfeld, J. Phys. Chem., 1962, v. 66, 1354-1356 3. И.Х.Терегулов, Р.А.Садыков, Изв.РАН, Сер. Хим.,1998, 1580-1583 4. Р.А. Садыков, У.М. Джемилев, Изв. АН, Сер. Хим., 1999, 1003-1005 5. Р.А. Садыков, М.Г. Самохина, У.М Джемилев, Изв. АН, Сер. Хим., 2001, 1262 - 1265 6. R.W.Fessenden, Schuler R.N., J.Chem. Phys, 1963,v 39, p. 2147-2195 7. A. Hadson, H.A. Hussian, 1969, v.16, 199-200 8. И.Х. Терегулов, Р. А. Садыков, А.В. Кучин, Металлорг. Химия, т.4. №1. 1991.141-146 9. А.Л. Бучаченко, Р.З. Сагдеев, К.М. Салихов, Магнитные и спиновые эффекты в химических реакциях , Наука , Новосибирск, 1978, 296 с. 10. R.W. Fessenden, J. Phys. Chem., 1967, v.71, 74-83. 11. R.W. Fessenden, R.H. Schuler, J. Chem. Phys., 1965, v.43, 2704-2712. 12. И.П. Грагеров, Л.А. Киприанова, А.Ф. Левит, Химическая поляризация ядер в исследовании механизма реакций органических соединений , Киев, Наукова Думка , 1985, 312 с. 13. Т.М.Дмитриева, Спектральное изучение взаимодействия между компонентами каталитических систем на основе ацетилацетонов переходных металлов , Кандид. Дисс., 1983, Иркутск, Иркутский Государственный Университет им.Жданова. 14. О.А. Реутов, И.П. Белецкая, Г.А. Артамкина, А.Н. Кашин, Реакции металлорганических соединений как редокс-процессы , Наука , М., 1981, 336 с. |
|
| |||