
|
| |||
|
Разделы
Главная
Сапромат
Моделирование
Взаимодействие
Методы
Инновации
Индукция
Исследования
Факторизация
Частоты
Популярное
Как составляется проект слаботочных сетей?
Как защитить объект?
Слаботочные системы в проекте «Умный дом»
Какой дом надежнее: каркасный или брусовой?
Как правильно создавать слаботочные системы?
Что такое энергоэффективные дома?
|
Главная » Фотолиз Фотолиз твердого раствора KClO4 - RbClO4 Халиуллин Р. Ш. (rafik@kemsu.ru), Леонтьева Е. В., Невоструев В. А. Кемеровский государственный университет Широкое применение кристаллических твердых растворов неорганических кислородсодержащих солей определяет интерес к изучению любых их свойств, в том числе фотохимических. К настоящему времени подробно изучено поведение индивидуальных перхлоратов щелочных металлов со структурой типа барита при облучении УФ-светом [1,2]. Систематического изучения фоторазложения твердых растворов не проводилось. Целью настоящей работы является исследование ионных и парамагнитных продуктов фотолиза катионного твердого раствора KClO4-RbClO4 во всем интервале концентраций. В работе использовали монокристаллы перхлоратов калия и рубидия, выращенные методом медленного охлаждения насыщенных растворов солей марки ч , дважды перекристаллизованных из бидистиллята. Смешанные кристаллы KtRtybClOi (0<х<1) выращивали сокристаллизацией при испарении из водных растворов при постоянной температуре (283К). Количественный состав твердого раствора определяли пламенно-фотометрическим (катионы калия) и рентгенофлуоресцентным (катионы рубидия) методами. Структуру образцов исследовали методами рентгенофазового анализа и ИК-спектроскопии диффузного отражения. Расчет параметров проводили исходя из пространственной группы Pnma методом МНК с использованием квадратичных форм ромбической сингонии. Установлено, что образуются твердые растворы замещения с аддитивной по Вегарду зависимостью параметров элементарной ячейки и частот основных колебаний перхлорат-аниона от состава. Кристаллическая решетка характеризуется статистическим трехмерным дальним порядком расположения катионов по узлам решетки, локальной деформацией элементарной ячейки и искажением ClO4- , вызванной неоднородностью ближайшего катионного окружения аниона. Образцы облучали на воздухе при 298 К нефильтрованным светом ртутной лампы низкого давления с кварцевой колбой (основные полосы излучения 185 и 254 нм в соотношении интенсивностей ~ 1: 10 соответственно). Расчет концентрации парамагнитных центров проводили методом сравнения с эталоном. Количественный химический анализ ионных продуктов фотолиза проводили спектрофотометрическим методом [1]. Идентичность структуры твердых растворов и индивидуальных перхлоратов [3] дает основания предполагать, что механизм и продукты фотолитического разложения также одинаковы. Следовательно, продуктами фотолиза KjJRb.ClO.! являются фрагменты распада перхлорат-аниона ClOn- где n = 0,1,2,3 и кислород. На рис.1 представлены кривые накопления 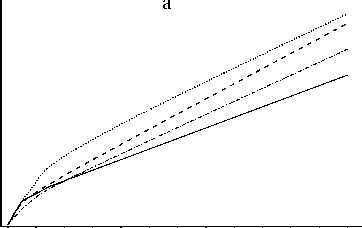 хлорсодержащих продуктов облучения УФ-светом перхлоратов калия и рубидия и твердых растворов KхRb(1.X)ClO4 разного состава. Одинаковый характер накопления продуктов (ZCT -рис.1а, Cl- -рис.1б, ClOn- n=1,2,3 - рис.1в) в твердых растворах и индивидуальных перхлоратах и стехиометрический баланс между концентрацией суммарного хлорида ZCl (общее разложение) и суммой концентраций хлорида и кислородсодержащих фрагментов перхлорат-иона: ZCl- = Cl-+ClOn- n=1,2,3 подтверждает высказанное предположение. То есть, продукты фотолиза твердых растворов такие же, как и в индивидуальных перхлоратах. Основным конечным продуктом является хлорид, его доля линейно растет с увеличением времени (дозы) воздействия УФ-излучения. Доля хлорида от общего разложения на начальном участке накопления примерно одинакова для всех образцов и составляет 30-40%. Образуется значительное количество хлорсодержащих фрагментов распада перхлорат-аниона ClOn- где n = 1,2,3. Химический анализ суммы окислителей ClO-, ClO2-, ClO2 показал, что их содержание на порядок ниже такового для ClO3-, поэтому данные по накоплению суммы ClOn- можно интерпретировать с небольшой поправкой как результаты накопления ClO3-. Тогда доля хлората составляет 60-70% от суммы продуктов фотолиза. 1017шт/см2 40 0 4 8 12 16 20 24 ч 1017шт/см2 30 0 4 8 12 16 20 24 ч 1017шт/см2 1050-1 0 4 8 12 16 20 24 ч .......... RbClCv- KCIO4---Ko,3Rbo,7 CIO4 - - - Ko,7Rbo,3 CIO4 Рис.1. Накопление хлорсодержащих продуктов распада перхлорат-аниона со временем фотолиза: а - ECl-, б - (Cl-), в - ClOn- n=1,2,3 Снижение эффективности фотолиза (общее разложение) с увеличением времени воздействия излучения есть результат вторичных фотостимулированных процессов, так как все потенциальные продукты первичного фотолиза ClOn- n=1,2,3 поглощают фотолизирующий свет (максимум поглощения для ClO3- составляет ~200 нм, ClO2- ~ 252 нм, ClO- ~ 300 нм), что подтверждает нелинейный характер накопления ClOn- со временем облучения. Кроме того, при длительном облучении на поверхности кристаллов образуется фаза хлорида, которая препятствует проникновению излучения вглубь образца. Полученные экспериментальные данные свидетельствуют о значительном сходстве процессов разложения в твердом растворе и чистых перхлоратах. Тем не менее, сравнительный анализ 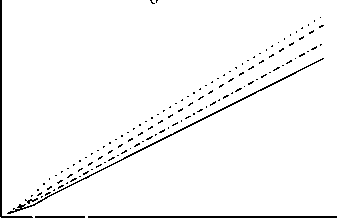  17 2 10 шт/см 8 7 6 5 а С 60 мол.% 1017шт/см2 8 7 6 5 1017шт/см2 3 2 1 0 б 1017шт/см2 0 100 С +, мол.% (рис.2) показывает, что эффективность общего разложения смешанных кристаллов заметно ниже, чем индивидуальных соединений или рассчитанных по аддитивной схеме значений, что, в свою очередь, обусловлено вкладом ClOn- (n=1,2,3). Тогда как концентрация Cl-линейно возрастает с увеличением концентрации рубидия в образцах в пределах ошибки эксперимента. 1017шт/см2 в 1017шт/см2 С +, мол.% Рис. 2. Зависимость концентрации продуктов фотолиза от состава образцов: а - ECl-, б -(Cl-), в - ClOn- n=1,2,3 Совокупность приведенных экспериментальных данных можно описать, основываясь наследующем механизме образования ионных продуктов фотолиза индивидуальных кристаллических перхлоратов, предложенном нами ранее[1]. В кристаллической матрице MClO4 (M= K, Rb и Cs) в силу эффекта клетки первичный фотохимический процесс разрыва одной из связей Cl -O приводит к образованию промежуточного комплекса ClO4- + hv -- [ClO3-, O(3P)] . (1) Комплекс имеет возможность трансформироваться по двум путям с учетом структурной неэквивалентности атомов кислорода исходного аниона ClO4- и его характерных внутри и межионных колебаний. В первом случае образуется атомарный кислород, который атакует эквивалентный кислород материнского аниона. Это приводит к внутриионной перестройке аниона: [ClO3-, O(3P)] - [ClO2-, O2] . (2) Во втором случае происходит межионная перестройка с участием соседнего аниона в зеркальной плоскости: [ClO3-, O(3P)] + ClO4-- [ClO3-, O2; ClO3-] (3) Присутствие в образцах ионов Cl- и ClO- есть результат вторичных фотостимулированных процессов, так как все стабильные продукты первичного фотохимического процесса ClO3-,ClO2-, O2- поглощают фотоионизирующий свет. При фотолизе ClO3- в матрице наблюдается процесс (4): ClO3- + hv - [ClO-, O2] (4) Молекулярный кислород под действием света 185нм диссоциирует в газовой фазе с квантовым выходом, равным единице, по реакции: O2 + hv - 2 0(3Р) (5) Образующийся при этом в матрице перхлората 0(3Р) может инициировать дальнейшие превращения окружающих его анионов: ClOn- + 0(3Р) - ClOn-1 + O2 , (6) где n = 1,2,3. Таким образом, совокупность реакций (1-6 ) объясняет пути образования при фотолизе перхлоратов щелочных металлов всех экспериментально обнаруженных ионных хлорсодержащих продуктов. Исходя из того, что воздействие энергии света носит случайный характер, процессы (2) и (3) практически равновероятны, поэтому первичное соотношение продуктов ClO2- и ClO3-должно составлять ~1:2. Доля хлорита в регистрируемых продуктах фотолиза очень мала, но, с другой стороны, ClO2- распадается под воздействием компоненты УФ-излучения 254 нм очень быстро и, очевидно, с образованием хлорида. В то же время концентрация ClO3-достаточно велика, практически на порядок больше чем ClO2- , то есть его разложение до хлорида протекает гораздо медленнее. Поскольку экспериментально обнаруживаемые концентрации ClOn- (n =1,2) незначительны, соответственно, на начальной стадии облучения основной вклад в образование хлорида вносит внутримолекулярный распад перхлорат-аниона. Полученное экспериментальное соотношение концентрации хлорида и хлората составляет ~1:2, что подтверждает справедливость приведенных рассуждений. В таком случае характер зависимостей концентрации продуктов фотолиза от состава твердых растворов можно интерпретировать следующим образом. Несмотря на изоструктурность компонентов, структура твердого раствора характеризуется нерегулярностью катионного окружения аниона, которая вкупе с различными поляризующими свойствами катионов калия и рубидия приводит к искажению перхлорат-аниона. Ввиду этого нарушается благоприятное для образования комплекса [ClO3-, O2, ClO3-] расположение перхлорат-анионов, что может привести к экспериментально наблюдаемому уменьшению концентрации ClO3- в твердых растворах по сравнению с индивидуальными перхлоратами. Ион Cl- является конечным продуктом распада ClOn- (n =1,2,3). Причем эффективность образования его определяется аддитивными свойствами кристаллической решетки, что следует из линейной зависимости выхода хлорида от состава. Предлагаемое объяснение носит качественный характер, причем понятие благоприятное расположение атомов весьма общее. Очевидно, в данном случае имеет значение расстояние между атомами кислорода соседних анионов. Может ли это расстояние измениться настолько, чтобы эффективность фотолиза снизилась практически на 50%? Параметры кристаллической решетки перхлората рубидия больше, чем перхлората калия. Это означает, что расстояние между соседними анионами в RbClO4 больше, чем в KClO4, и, тем не менее, эффективность образования хлората в первом случае выше. Следовательно, существует другая причина, определяющая снижение эффективности образования хлората в двойных системах. С геометрической точки зрения необходимым условием образования [ClO2-,O2], [ClO3-,O2 , ClO3-] из [ClO3-, O(3p)] и Cl- из ClO2-, является сближение атомов кислорода одного перхлорат-иона О(1и2) в первом случае, атомов кислорода О(3 или4) соседних анионов во втором и атомов кислорода ClO2- в третьем случае. Данное условие может реализоваться в процессах внутримолекулярных колебаний: v2(E), v1(A1) соответственно. Энергия внутримолекулярных колебаний Cl-O связей перхлорат-аниона непосредственно связана со свойствами как самого ClO4-, так и его окружения, поэтому любые искажения структуры отражаются на колебаниях молекул. Применяя упрощенный критерий взаимосвязи частоты колебаний (энергии) и прочности связи (чем выше энергия, тем прочнее связь) к индивидуальным перхлоратам калия и рубидия, получаем, что эффективность образования хлорида (v2(E)) и хлората v1(A1) в KClO4 ниже, чем в RbClO4, что соответствует действительности. Сравнивая частоты колебаний связей Cl-O твердых растворов и чистых соединений, получаем, что концентрация хлорид-иона должна линейно меняться с составом, а хлорат-иона - с отрицательным отклонением от аддитивности. Данный вывод согласуется с экспериментальными результатами, что позволяет заключить: образование ионных продуктов при фотолизе перхлоратов, как индивидуальных, так и твердых растворов протекает с участием внутримолекулярных колебаний связей Cl-O, прочность (энергия) которых определяет эффективность фотохимического разложения. Регулярность катионного окружения влияет на энергию колебаний. В принципе, эта гипотеза не противоречит качественному объяснению особенностей фотолиза двойной системы и объясняет суть процесса с энергетической точки зрения. Облученные УФ- светом монокристаллы индивидуальных перхлоратов и твердых растворов KjjRtybClO для х = 35 и 70мол% исследовали методом ЭПР. После непрерывного облучения в течение 24 часов на воздухе зарегистрировано образование парамагнитных центров (ПЦ), идентифицированных как O3-, [O3-,O2], ClO2, ClO3. Факт образования ПЦ при фотолизе неорганических кислородсодержащих солей светом, энергия которого меньше ширины классической запрещенной зоны, объясняется особенностями зонной структуры, а именно наличием анионной зоны проводимости, энергия которой сопоставима с энергией кванта фотолизирующего света. Сравнительный анализ эффективности образования ПЦ в образцах разного состава показывает, что их концентрации меньше рассчитанных по строго аддитивной схеме. Вероятно, это следствие искажения кристаллической решетки твердых растворов, что с энергетической точки зрения означает повышение энергии. На основании полученных данных можно заключить, что продукты и механизм фотолиза твердых растворов и индивидуальных перхлоратов одинаковы. Различие выходов образования продуктов определяется искажениями структуры перхлорат-аниона, обусловленными неоднородностью катионного окружения. Это приводит к повышению энергии внутримолекулярных колебаний перхлорат-иона, которые играют существенную роль в процессах формирования ионных продуктов фотолиза. Литература 1. Khaliullin R. Sh., Kriger L. D. Sci. Appl. Photo.2000, V.42 N4, PP.331-337 2. Klaning U.K. et al. J.Chem.Soc., Faraday Trans.I.-1982.V.78, N.6.P.1835-1839 3. Халиуллин Р.Ш., Хисамов Б.А., Пугачев В.М. Ж физ. химии .1991. Т.65, №6.С.1517- 1521 |
|
| |||